「 行业资讯 」仅靠WB、IF和流式细胞术做出20分巨作
有创新的科研思路+巧妙的实验设计也是能俘获编辑的青睐,这篇文章(Intestinal E. coli-produced yersiniabactin promotes profibrotic macrophages in Crohn’s disease)通过展示WB和免疫荧光等基础实验结果,就能发表在Cell Host & Microbe杂志(IF 20.33’)上。
摘要:
炎症性肠病(IBD)相关纤维化会导致发病率显著增加,但其机制尚不清楚,目前有研究表明其涉及微生物群,特别是粘附侵袭性大肠杆菌(AIEC)。
此前,在IBD小鼠模型中,研究者们已证明AIEC产生的金属因子Ybt可促进肠道纤维化。在本次研究中,研究者们首先发现巨噬细胞在人类IBD纤维化组织和小鼠纤维化病变中大量存在,且与AIEC共定位。Ybt可通过低氧诱导因子1- α (HIF-1α)的稳定和核易位诱导巨噬细胞中纤维化基因的表达。HIF-1α是一种金属依赖性免疫调节剂,HIF-1α+巨噬细胞定位于人类IBD纤维化狭窄和小鼠纤维化病变的疾病活动部位。
该研究结果揭示了产生Ybt的AIEC通过抑制锌依赖的HIF-1α羟基化来消耗巨噬细胞内的锌并稳定HIF-1α,即微生物群介导的金属隔离是炎症肠道中靶向巨噬细胞的促纤维化触发器。
介绍:
炎症性肠病(IBDs),包括克罗恩病(CD),涉及遗传易感宿主对肠道微生物的异常免疫反应,并引发慢性肠道炎症和相关的合并症。
其中肠纤维化是一个重要的并发症,目前尚无已知的病因和有效治疗方法。IBDs相关纤维化的CD患者,在出现严重的肠道增厚、狭窄和梗阻后一般会手术切除肠道,但术后瘢痕和狭窄经常复发,这提示肠道微环境中的某些物质驱动CD相关纤维化。
目前有多项报道显示微生物群与CD相关的纤维化发展有关,其中肠道常驻大肠杆菌(E. coli)菌株,特别是那些被定义为粘附-侵袭性大肠杆菌(AIEC)的菌株,在IBDs病变肠道中分离的大肠杆菌菌株中占比多达80%。
长期发炎的肠道是宿主和常驻微生物争夺营养物质的战场,包括铁和锌等生物上重要的金属。
宿主通过高亲和力的金属结合蛋白隔离这些必需金属来保护自己免受病原体的侵害,而细菌则通过在肠道等低金属环境中分泌其独有的高亲和力金属结合小分子——金属基团,以支持定植和毒性。Ybt便是一种金属载体,普遍存在于人、犬和小鼠AIEC菌株中。
巨噬细胞对宿主防御病原体和抑制微生物群成员的组织定植至关重要。巨噬细胞通常激活成纤维细胞、分泌生长因子,促进ECM的沉积和重塑,以修复受损组织,促进伤口愈合。然而,过度活化的巨噬细胞使得成纤维细胞长时间活化、增殖和分化,导致ECM过度沉积和肠道发生纤维化。微生物感染和金属可用性都是巨噬细胞促炎和促纤维化活动的强调节剂。
结果:
1.巨噬细胞在CD患者和IBD小鼠模型的纤维化病变中大量存在
研究者们之前已证明,与单一产生Ybt的AIEC菌株NC101共生的 Il10 - / -小鼠(一种已建立的IBD模型)可发生炎症相关的纤维化,而在用产生 Ybt 的野生型 (WT) NC101 或 DfyuA NC101(无法摄取/利用 Ybt 但仍能产生Ybt)定植 10 周后,超过 40% 的Il10 - / -小鼠出现了肠道纤维化,然而,定植了缺乏 Ybt 的 NC101(Dirp1 或 Dirp1DfyuA)的Il10 - / -小鼠很少发生纤维化。这些发现表明,细菌产生Ybt而非利用Ybt才是促纤维化作用所必需的,即Ybt可以直接靶向宿主。
因此,为了评估产生Ybt的细菌是否在IBD患者中比在一般非IBD人群中更常见,他们从 MetaHIT 和 HMP2 中挖掘了克罗恩病 (CD) 患者和非 IBD 对照组的宏基因组和宏转录组数据,以寻找 Ybt 生物合成基因。
果不其然,CD 患者中 Ybt 的合成基因比非 IBD 患者更丰富。此外,他们观察到在纤维化Il10 - / -小鼠的结肠固有层、粘膜下层和肌层中存在大量的 F4/80+ 巨噬细胞(图 1A)。大肠杆菌与富含 F4/80+ 巨噬细胞的粘膜下层纤维化病变共定位,并且如预期的那样,附着在上皮细胞上(图 1B)。
通过流式细胞术对粘膜组织(包括肠道)中的髓系细胞进行免疫表型分析,对纤维化和非纤维化结肠组织进行分析之后,他们发现,纤维化小鼠体内存在大量的F4/80+主要组织相容性复合体II类(MHC II类,MHC II)阴性细胞,这些细胞可能是活化的单核细胞和/或巨噬细胞(图1C)。而通过CD24和CD64的进一步流式分析,也表明这些细胞可能是募集的炎症单核细胞和巨噬细胞。
随后,他们通过从具有产生ybt的NC101定植的Il10 - / -小鼠(包括非纤维化和纤维化疾病)中分离结肠CD11b+细胞。结果显示,在纤维化小鼠的CD11b+结肠细胞中,Emr1(F4/80)和H2-Aa(MHC II类)基因的高表达,再次表明,在纤维化小鼠的结肠髓系群体中巨噬细胞丰富(图1D)。
接下来,为了确定巨噬细胞是否是人CD纤维化肠的显著特征,他们对健康人全层结肠切除组织和患有肠道炎症的人(即憩室炎、溃疡性结肠炎[UC],少发生纤维化)的CD68+人巨噬细胞进行了染色(图1E)。观察到CD68+细胞在CD纤维化患者中不仅浸润固有层,而且浸润粘膜下和肌肉层。基于巨噬细胞在AIEC吞噬/杀伤中的重要作用,他们假设巨噬细胞被AIEC产生的Ybt异常激活,并促进炎症相关的肠道纤维

图1.巨噬细胞在CD患者和IBD小鼠模型的纤维化病变中大量存在
图(A和B)为结肠卷的免疫荧光染色;(C)流式细胞术分析结肠细胞,CD45+、F4/80+和MHC II类(MHC II)阴性巨噬细胞的百分比。(D)通过磁珠下拉分离结肠CD11b+细胞,RT-qPCR量化Emr1 (F4/80)和H2-Aa (MHC II类,MHC II类),非纤维化和纤维化样本的数据归一化为非纤维化组的平均值ΔCt,得出相对于非纤维化样本的基因折叠变化。非纤维化,n = 5,纤维化,n = 2。(E)正常、憩室炎、溃疡性结肠炎(UC)和克罗恩病(CD)患者结肠组织中巨噬细胞的代表性免疫荧光染色,CD68(绿色)、DAPI(蓝色)。LP,固有层;SM,黏膜下层;MP,固有肌层。
2. AIEC产生的Ybt可稳定巨噬细胞中的HIF-1α
HIF-1α是一种已知的促纤维化介质,在上皮细胞和成纤维细胞中已有报道。在髓细胞中,细菌感染激活HIF-1α,而已知HIF-1α介导巨噬细胞在慢性炎症期间对细胞内细菌的杀伤和组织重塑。为了检测巨噬细胞中的HIF-1α,他们用产生Ybt的(Ybt+ WT)和Ybt缺陷突变体(Δirp1) NC101感染巨噬细胞(图2A),并检测到核HIF-1α,但未检测到ybt缺陷Δirp1(图2B)。
事实上,Ybt+ NC101诱导核HIF-1α在J774巨噬细胞、小鼠骨髓源性巨噬细胞(BMDM)和小鼠腹膜渗出细胞(PEC)中大量积累,而不受Ybt缺陷Δirp1 NC101的诱导(图2B)。为了验证HIF-1α的定位,他们采用免疫细胞化学(ICC)方法测量了Ybt+ NC101对J774细胞核中HIF-1α的反应强度(图2C)。为了在缺乏其他微生物信号的情况下直接测试Ybt的作用,他们将J774巨噬细胞暴露于纯化的无金属载体Ybt中,并观察到核HIF-1α的有效稳定(图2D)。
此外,为了评估Ybt在HIF-1α稳定中的特异性,他们设计了NC101铁载体突变体和补体菌株。将纯化的Ybt添加到感染Δirp1菌株的巨噬细胞中也恢复了HIF-1α的稳定性(图2F)。总的来说,这部分的数据证明了AIEC产生的Ybt在巨噬细胞中促进HIF-1α稳定和核易位的特异性。
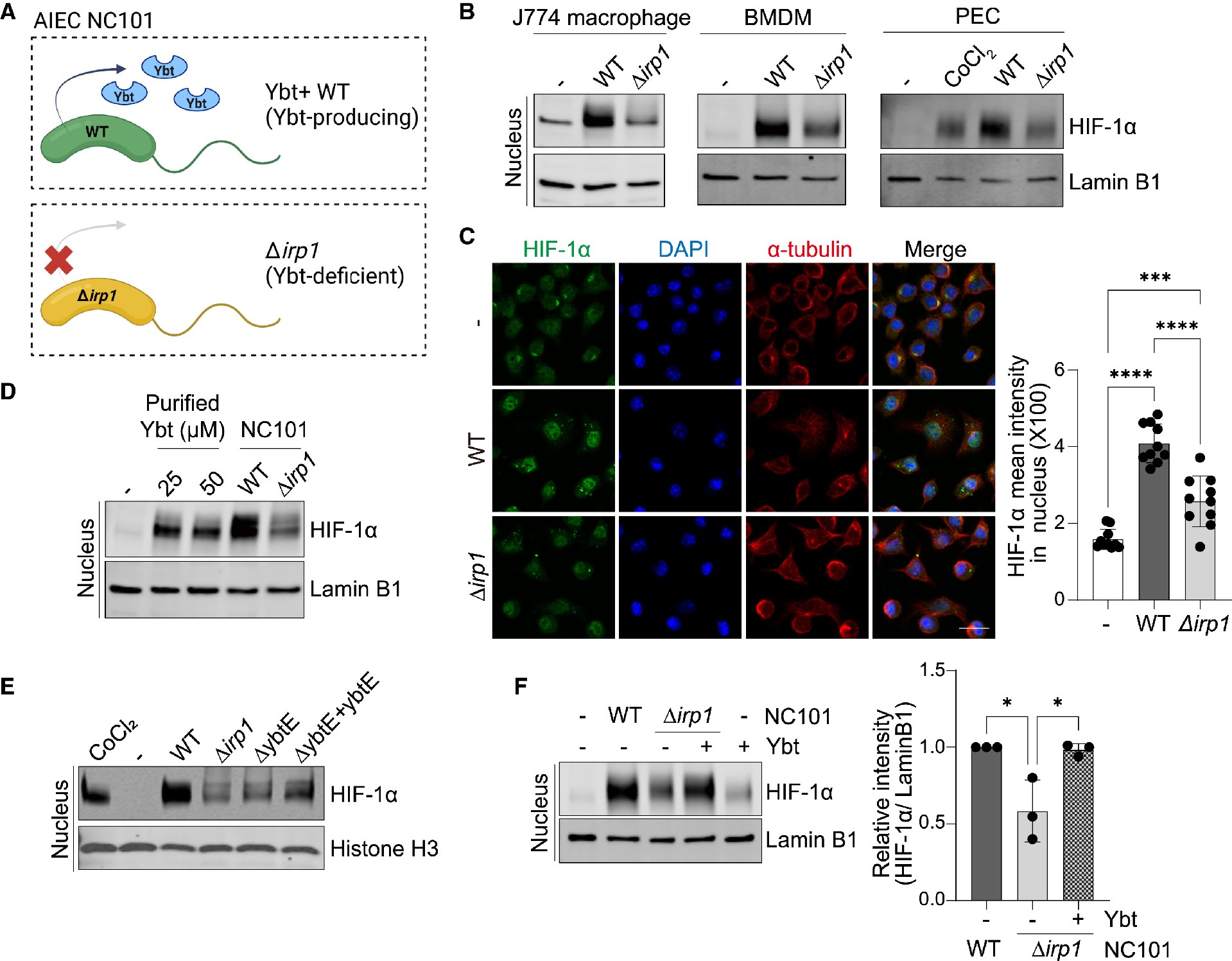
图2.AIEC产生的Ybt稳定巨噬细胞中的HIF-1α
-
(A) AIEC NC101细菌基因型/表型示意图:irp1基因的缺失(Δirp1)使该菌株缺乏ybt。
-
(B) J774、骨髓源性巨噬细胞(BMDMs)或腹膜渗出细胞(PECs)的核提取物检测HIF-1α和层粘胶蛋白B1。
-
(C)J774细胞免疫荧光图像,HIF-1α(绿色)、α-微管蛋白(红色)、DAPI(蓝色)。
-
(D) J774细胞用纯化的Ybt (25 μM和50 μM)处理4 h。
-
(E) BMDMs感染WT、Δirp1、ΔybtE或ΔybtE + ybtE (ybtE染色体补体株)NC101,核提取物检测HIF-1α和组蛋白H3。
-
(F)用WT或Δirp1 NC101感染J774细胞和/或用纯化的10 μM Ybt处理4小时,用核提取物检测HIF-1α和层粘胶蛋白B1(左)。
3. Ybt以锌依赖的方式稳定巨噬细胞HIF-1α
Ybt是一种独特的金属蛋白,可以结合铁和锌,而锌的稳态对巨噬细胞功能至关重要。因此,研究者们探索了与Ybt结合的铁或锌是否能诱导巨噬细胞中HIF-1α的激活。他们发现添加锌和铁可以抑制了纯化Ybt诱导的J774巨噬细胞HIF-1α核稳定(图3B)。此外,补锌可以恢复Ybt+ NC101感染的BMDMs中HIF-1α水平(图3C)。J774巨噬细胞的电感耦合等离子质谱(ICP-MS)显示,虽然细胞内铁浓度不受影响,但感染Ybt+ NC101的细胞内锌水平降低(图3D)。
因此他们推断,暴露于化学锌螯合剂或可类似地提高HIF-1α蛋白水平。通过western blot和ICC显示,膜渗透性锌螯合剂TPA和TPEN增加了核HIF-1α水平(图3E和3F)。这些结果表明,AIEC 产生的金属载体 Ybt 在巨噬细胞中通过锌依赖性途径激活HIF-1a ,这一发现也适用于其他类型的细胞。
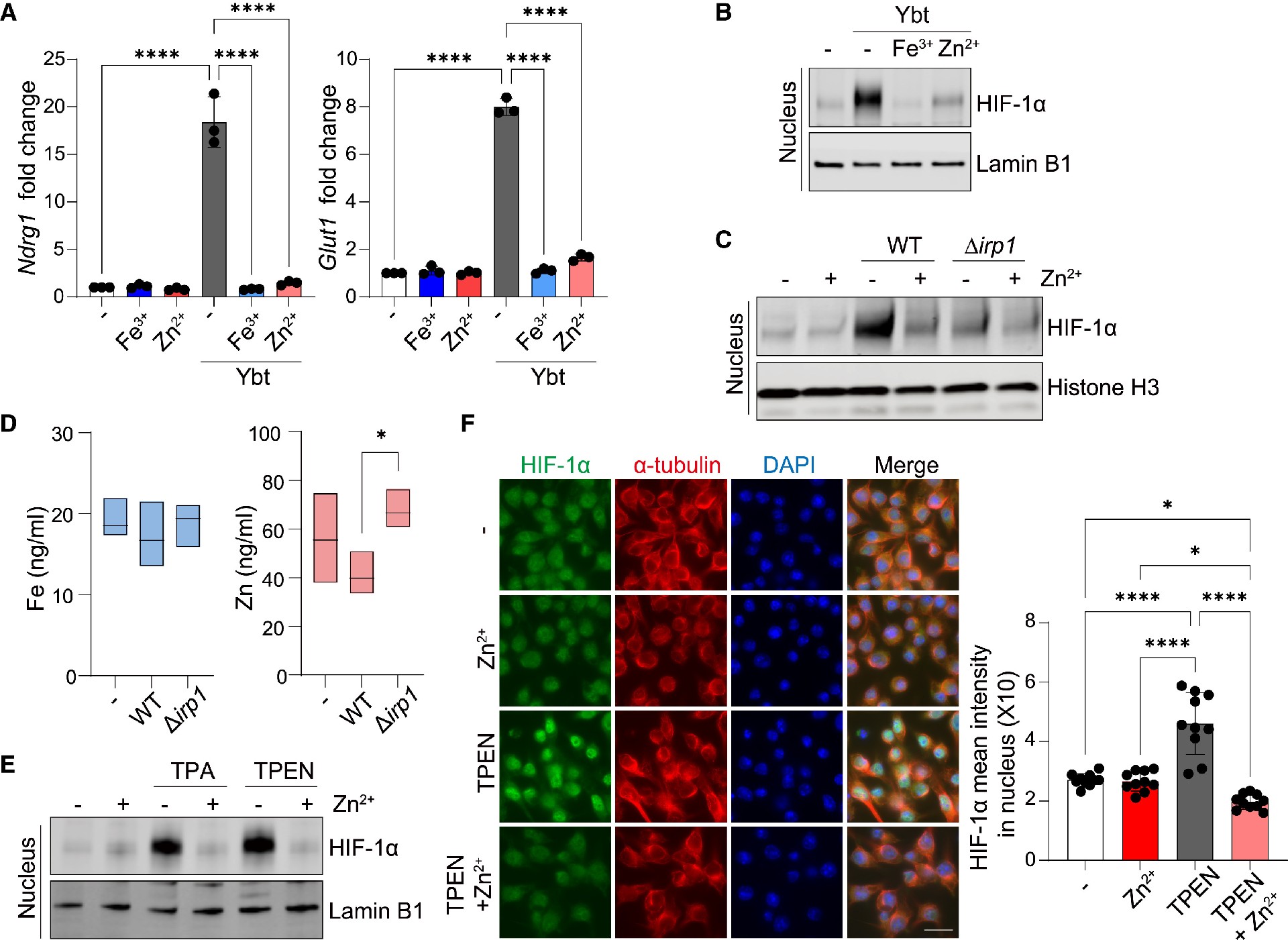
图3.Ybt以锌依赖的方式稳定巨噬细胞HIF-1α
-
(A) RT-qPCR分析J774巨噬细胞基因表达。
-
(B) WB检测核提取物中HIF-1α和层粘胶蛋白B1的含量。
-
(C) 10 μM Zn2+和/或WT或Δirp1 NC101感染BMDMs 4 h,检测核提取物中HIF-1α和组蛋白H3的含量。
-
(D)ICP-MS法测定J774细胞感染后的铁(Fe)和锌(Zn)浓度。
-
(E、F) J774细胞分别用锌螯合剂、1 μM TPA、5 μM TPEN和/或10 μM Zn2+处理。(E)核提取物检测HIF-1α和层粘胶蛋白B1。(F)对HIF-1α进行免疫细胞化学(左),测定核HIF-1α的平均强度(右)。
4. Ybt以锌依赖的方式抑制HIF-1α羟基化
在稳态条件下,HIF-1a 的水平通过 PHD 介导的羟基化和随后的蛋白酶体介导的降解来控制。其中异构体PHD2(由EGLN1编码)是HIF-1α的主要调节因子,在髓细胞中病原体诱导的HIF-1α活化中起重要作用。因此,抑制PHD2在药理学上可以使HIF-1α稳定、核易位和HIF-1α调控基因的转录。
为了研究抑制PHD活性是否能增强巨噬细胞HIF-1α的稳定性,他们以PHD抑制剂处理aiec感染的细胞并检测Ybt+和Ybt缺陷Δirp1 NC101的HIF-1α水平(图4A和4B)和HIF-1α羟基化(HIF-1α - OH)的程度,发现HIF1α -OH是由缺乏Ybt的Δirp1感染诱导的,而不是由Ybt+ NC101诱导的(图4C)。IOX4处理抑制PHD2可降低HIF1α-OH,但不改变PHD2的蛋白水平(图4C),这表明Ybt破坏了PHD2的酶活性而不是蛋白水平。
接下来研究者们推断,锌螯合是否可以恢复PHD活性并降低细胞核HIF-1α水平。结果表明,在感染Ybt+ NC101后,添加锌后HIF1α - OH增强,细胞核HIF-1α水平降低(图4D)。
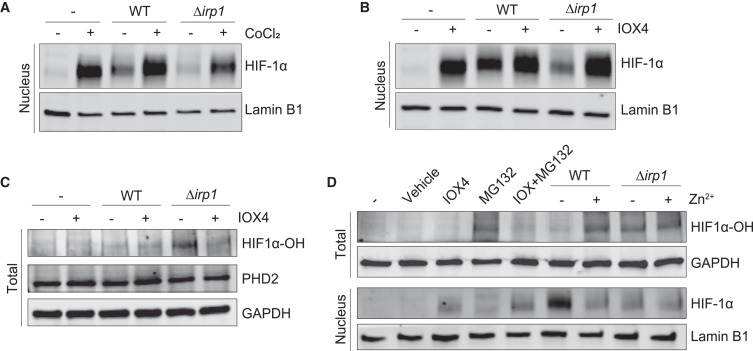
图4.Ybt以锌依赖的方式抑制HIF-1α羟基化
5. Ybt诱导HIF-1α依赖性纤维化基因表达
前期已证明,Ybt+ NC101单定植Il10 - / -小鼠发生炎症相关纤维化,纤维化ECM基因表达增加。为了研究巨噬细胞上的特异性反应,研究者使用纯化的Ybt处理J774巨噬细胞,并在4小时后检测基因表达(图5A)。显示与纤维化介质相关的众多基因上调(图5A)。
为了研究这种Ybt诱导的纤维化反应是否依赖于巨噬细胞HIF-1α,他们设计了HIF-1α敲除(KO)的J774细胞,并感染了NC101(图5B)。用Ybt处理HIF-1α WT和KO J774细胞24小时,评估图5A中的一个纤维化基因子集表达变化,结果发现Ybt诱导的HIF-1α应答基因(图5C)、促纤维化基因在HIF-1α KO细胞中的表达减少(图5D)。这些研究结果强烈提示,暴露于Ybt的巨噬细胞直接产生ECM重塑和促纤维化因子,这些因子或通过旁分泌信号激活周围的成纤维细胞,建立促进肠道纤维化的促纤维化微环境。
为了进一步确定Ybt诱导巨噬细胞中HIF-1α的激活是否对激活附近的成纤维细胞很重要,他们建立了J774巨噬细胞和3T3成纤维细胞的体外共培养系统,模拟肠道中的相互作用共培养物分别接种WT或HIF-1α KO巨噬细胞,直接测试巨噬细胞HIF-1α活化对成纤维细胞活化的贡献。研究者们用Ybt+ NC101感染共培养物,使巨噬细胞和成纤维细胞暴露于产生Ybt的细菌。4 h后,再用庆大霉素杀死细胞外细菌,并维持共培养48 h,以评估促纤维化基因的表达。
Western blot分析显示,正如预期的那样,大多数巨噬细胞在感染后48小时死亡,剩余的活细胞为成纤维细胞(图5E)。因此,之前在感染后48小时测量的主要基因特征归因于成纤维细胞而不是巨噬细胞。随后,他们测量了该成纤维细胞的基因表达,包括那些代表MMPs、ECM和生长因子的基因,并发现某些基因可被细菌诱导,并受巨噬细胞HIF-1α显著调控(图5F;Fn1、Mmp2和Mmp9),而其他的则不受巨噬细胞HIF-1α的影响。
总之,这部分研究结果表明,巨噬细胞中的HIF-1α调节成纤维细胞的激活和一些关键纤维化相关基因的表达,这种巨噬细胞-成纤维细胞的相互作用在纤维化对细菌感染的反应中十分重要。
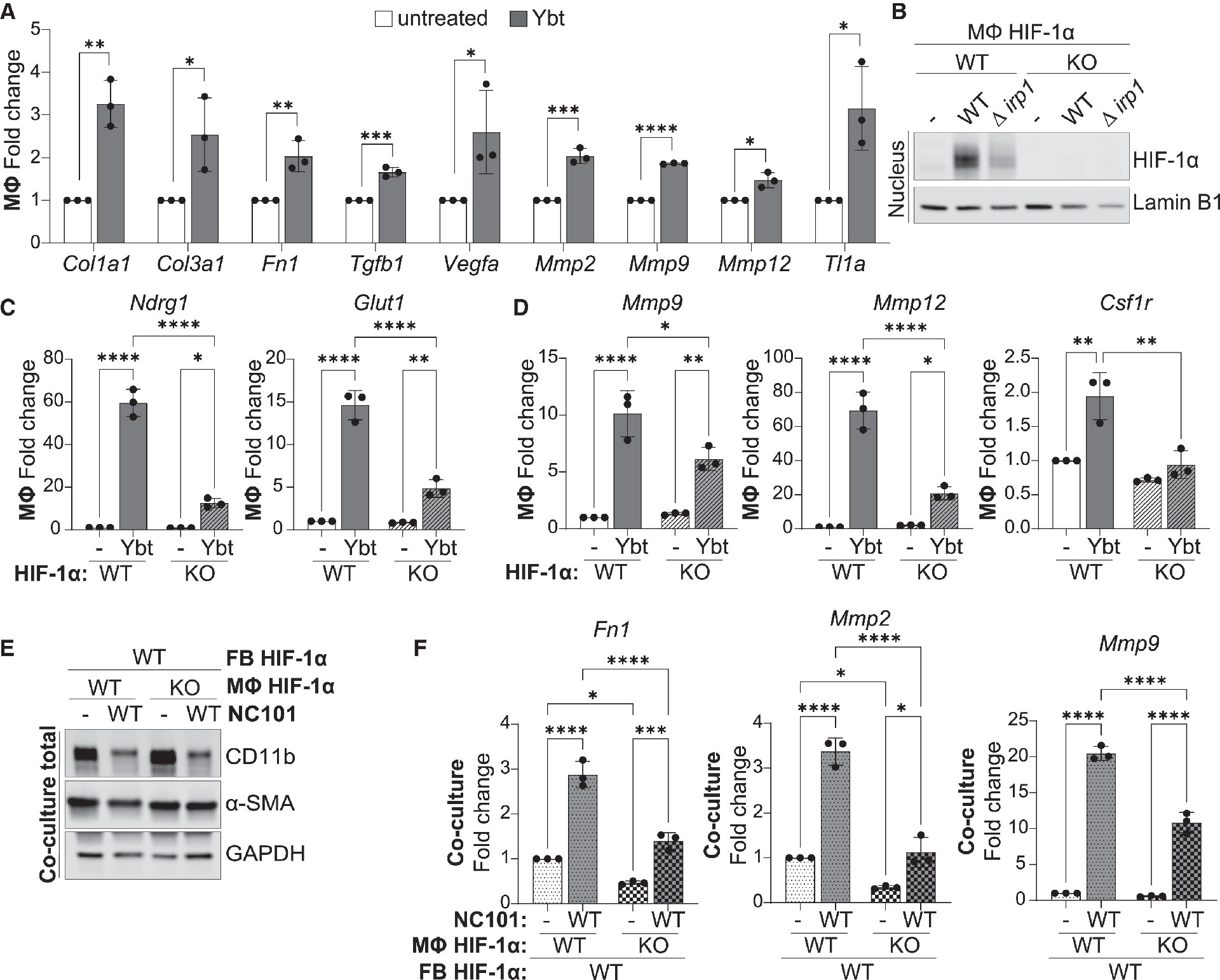
图5.Ybt诱导HIF-1α依赖性纤维化基因表达
-
(A)RT-qPCR分析J774细胞中原纤维化基因的表达。
-
(B-D)CRISPR技术构建HIF-1α(KO)J774细胞。
-
(B) J774巨噬细胞(Φ)用WT或Δirp1 NC101感染HIF-1α WT和KO细胞,并用核提取物检测HIF-1α和层粘胶蛋白B1。
-
(C和D) RT-qPCR分析HIF-1α应答基因(C)和纤维化基因(D)的表达情况。
-
(E和F) J774巨噬细胞(Φ) HIF-1α WT和KO与3T3成纤维细胞(FB)共培养14天。(E)共培养总细胞裂解液检测CD11b(髓细胞标志物)、α-SMA(平滑肌肌动蛋白,成纤维细胞标志物)和GAPDH。
-
(F)与未感染的WT细胞(Φ: WT(FB)细胞)相比,原纤维化基因表达量与上述测量结果相同。
6. 活化核HIF-1α的巨噬细胞标记人CD狭窄和小鼠纤维化病变
已有研究报道过HIF-1α与炎症性肠病 (IBD)、CD患者 和 CEABAC10 转基因小鼠模型的相关性。因此,研究者们先假设HIF-1α+巨噬细胞可标记促纤维化活性区域。为了探究纤维化病理与巨噬细胞 HIF-1a 激活之间的相互关系,他们评估了Il10 - / -小鼠模型纤维化组织以及来自CD患者狭窄的人回盲和结肠切除组织中HIF-1α+巨噬细胞的丰度和定位。
在与Ybt+ NC101 单一共生的纤维化Il10 - / -小鼠组织中,核HIF-1α与纤维化病变的粘膜下层和固有层中的 F4/80+巨噬细胞共定位(图6B)。相反,发生炎症但未发生纤维化的小鼠仅显示微弱的F4/80信号(图6A),且无法观察到核HIF-1α(图6A)。5名克罗恩病纤维化患者的组织病理检测显示,与狭窄相邻的非纤维化回肠手术边缘组织表现出很少的 CD68+ 巨噬细胞或核HIF-1α染色(图 6C);相比之下,狭窄上方的固有层表现出明亮且丰富的CD68+巨噬细胞,以及核HIF-1α染色(图6D),并存在统计学上的显著增加(图6E)。
这些结果表明,表达核HIF-1α的巨噬细胞定位于CD患者和IBD-纤维化小鼠模型的狭窄组织的纤维化疾病部位IBD。总之,这些数据支持一个模型,在这个模型中,巨噬细胞与炎症肠道中产生Ybt的AIEC相互作用诱导HIF-1α稳定,编程纤维化巨噬细胞激活,促进CD患者的纤维化。
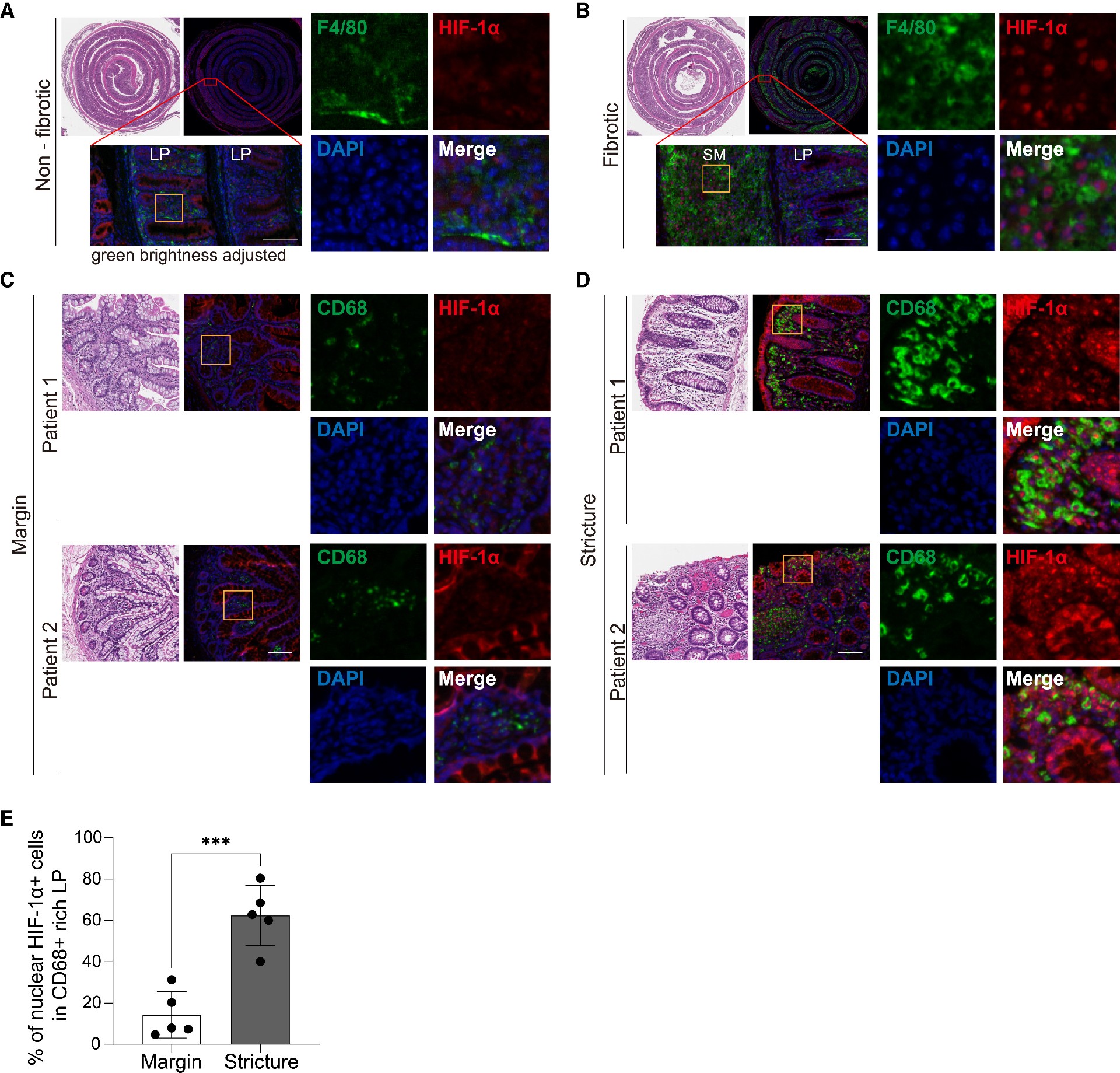
图6.活化核HIF-1α的巨噬细胞标记人CD狭窄和小鼠纤维化病变
-
(A和B)H&E和免疫荧光染色小鼠结肠非纤维化(A)和纤维化(B)病变的代表性图像,右图为放大图像。F4/80(绿色)、HIF-1α(红色)和DAPI(蓝色)。可见非纤维化组织的巨噬细胞,绿色信号较纤维化组织增加3倍。
-
(C和D)纤维化狭窄性疾病的人CD患者回结肠切除组织的代表性图像,包括回肠近端手术缘(C)和回盲部狭窄(D)。连续切片采用H&E和免疫荧光染色,右图为放大图像。CD68(绿色)、HIF-1α(红色)和DAPI(蓝色)。
-
(E)利用ImageJ定量分析边缘组织富含CD68+区与狭窄组织富含CD68+区固有层(LP)中核HIF-1α+细胞的百分比。







